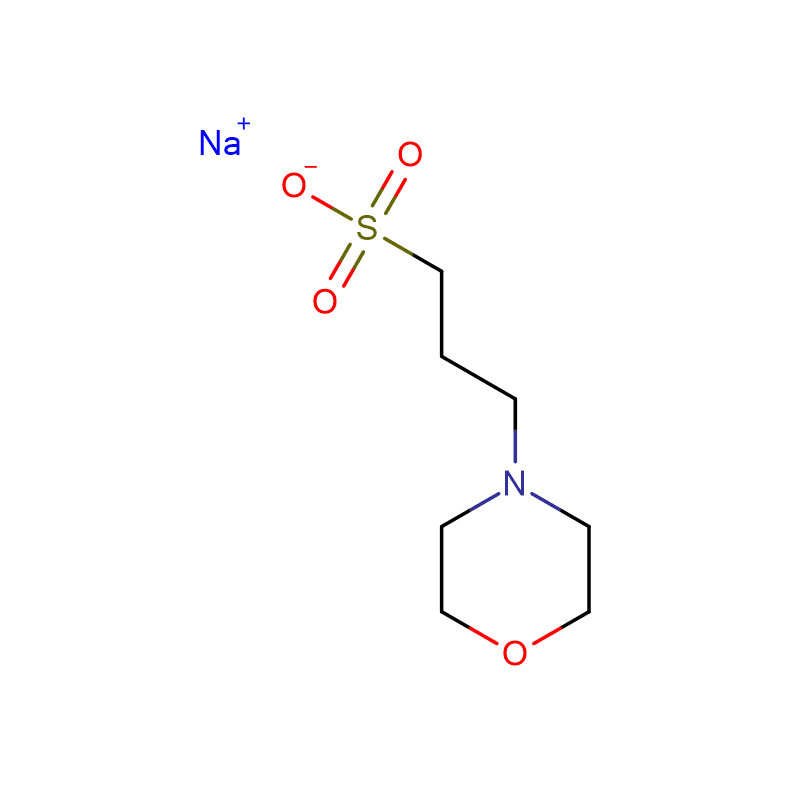
HEPBS Cas:161308-36-7 N- (2- Hidroksietil) piperazino- N'- (4- butansulfona acido) Blanka kristala pulvoro 99%
| Katalogo-Numero | XD90100 |
| Produkta Nomo | HEPBS |
| CAS | 161308-36-7 |
| Molekula formulo | C10H22N2O4S |
| Molekula pezo | 266.36 |
| Detaloj pri Stokado | Ambient |
| Harmonigita Tarifa Kodo | 2933599090 |
Specifo de Produkto
| Aspekto | Blanka kristala pulvoro |
| Assay | ≥ 99% |
| Stokado Temp | Vendu ĉe RT |
| Fandpunkto | 211-216 °C |
| Acideckoeficiento (pKa) | 8.3 (je 25 ℃) |
Ni komprenas la gravecon protekti la integrecon de viaj biomolekuloj kaj reakciiloj per la ĝustaj bufraj sistemoj.Niaj biologiaj bufroj provizas solvstabilecon kaj pH-kontrolon sen malhelpi biologiajn procezojn, kaj provizas kritikajn salojn kaj nutraĵojn por ĉeloj kaj histoj.Niaj altnivelaj bufraj sistemoj povas alporti al vi fenomenan stabilecon en ĉelkulturo, polimeraza ĉena reago (PCR), ekzamenado de drogoj, bioprocesado, purigado kaj finaj formulaj aplikoj.Ĉiuj niaj produktoj povas esti skalataj de frua esplorado ĝis komercaj aplikoj en diversaj bufrogradoj.Ni ofertas multajn pakajn agordojn, laŭmendan miksadon kaj eĉ likvan formulon.
Ni ankaŭ provizas ampleksan elekton de altkvalitaj biokemiaĵoj en praktika gamo da gradoj kaj en diversaj novigaj, uzant-amikaj pakaj opcioj.Krom vendotaj produktoj, ni ofertas laŭmendan reakciilon fabrikadon, miksadon kaj pakadon por plenumi viajn bezonojn.
La funkcia principo kaj pH-valoro de bufra solvaĵo Kiam certa kvanto da acido kaj alkalo estas aldonita al iuj solvaĵoj, ĝi havas la efikon malhelpi la pH-ŝanĝon de la solvaĵo, kiu nomiĝas bufra efiko.Tia solvo nomiĝas bufrosolvo.Miksitaj solvaĵoj de malfortaj acidoj kaj iliaj saloj (kiel ekzemple HAc kaj NaAc), kaj miksitaj solvaĵoj de malfortaj bazoj kaj iliaj saloj (kiel ekzemple NH3·H2O kaj NH4Cl) estas bufrosolvoj.La bufra efiko de la bufrosolvo kunmetita de la malforta acido HA kaj ĝia salo NaA sur la acido ŝuldiĝas al la ĉeesto de sufiĉa kvanto de alkala A- en la solvaĵo.Kiam certa kvanto da forta acido estas aldonita al ĉi tiu solvaĵo, H-jonoj estas esence konsumitaj de A- jonoj: do la pH de la solvaĵo estas preskaŭ senŝanĝa;kiam certa kvanto de forta bazo estas aldonita, la malforta acida HA ĉeestanta en la solvaĵo konsumas OH- jonojn malhelpas la ŝanĝon de pH.



![TAPS-NA Cas:91000-53-2 Likva 99% N-[Tris(hidroksimetil)metil]-3-aminopropansulfona acida natria salo](http://cdn.globalso.com/xdbiochems/91000-53-2.jpg)